Уравне́ние состоя́ния - 1) термическое уравнение состояния выражает связь между давлением р, температурой Т и удельным объёмом v (или плотностью ρ) гомогенного вещества в состоянии равновесия: f(р, Т, v) = 0.
2) Калорическое уравнение состояния выражает зависимость какой-либо калорической величины (внутренней энергии, энтальпии, энтропии и т. п.) от термодинамических параметров, например от р и Т или v и Т. Из уравнений состояния для различных агрегатных состояний наиболее обоснованы уравнения состояния для газов. Уравнение состояния моля идеального газа: р = RT/v, где R - газовая постоянная (см. уравнение Клапейрона). Для реальных газов применяют вириальное уравнение состояния:
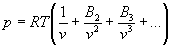 ,
,
где В2, В3... - 2-й, 3-й и т. д. вириальные коэффициенты, отражающие взаимодействие молекул и являющиеся функциями температуры (см. также уравнение Ван дер Ваальса).
* * *
УРАВНЕНИЕ СОСТОЯНИЯ - УРАВНЕ́НИЕ СОСТОЯ́НИЯ,
1) термическое уравнение состояния выражает связь между давлением p, температурой Т и удельным объемом v (или плотностью r) гомогенного вещества в состоянии равновесия: f(p,T,v)=0.
2) Калорическое уравнение состояния выражает зависимость какой-либо калорической величины (внутренней энергии, энтальпии, теплоемкости и т. п.) от р и Т или v и Т. Из уравнения состояния для различных агрегатных состояний наиболее обоснованы уравнения состояния для газов. Уравнение состояния моля идеального газа r=RT/v, где R - газовая постоянная (см. Клапейрона уравнение (см. КЛАПЕЙРОНА УРАВНЕНИЕ)). Для реальных газов применяют вириальное уравнение состояния
,
где В2, В3... - 2-й, 3-й и т. д. вириальные коэффициенты, отражающие взаимодействие молекул и являющиеся функциями температуры (см. также Ван-дер-Ваальса уравнение (см. ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ)).